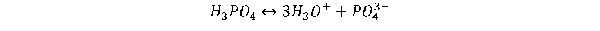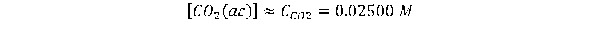CURVAS DE VALORACIÓN EN SISTEMAS ACIDO – BASE COMPLEJOS
OBJETIVOS
El objetivo principal del blog es el de permitir:
- Opinar,
- Enseñar,
- Colaborar,
- Contribuir,
- Intercambio de información,
- Compartir conocimiento,
- Transformar el conocimiento,
- Transformar las actitudes y aptitudes de los estudiantes,
- Y, estudio colaborativo en todos los niveles, etc.
Nuestra MISION principal, con el diseño del blog es la de TRANSFORMAR las actitudes de las personas que son del pensar en que se enseña y se aprende de una sola manera. Con el advenimiento de la tecnología, la educación cuenta con un nuevo escenario integrador e innovador que les permitirá el realizar sus comentarios y aportaciones en un foro totalmente educativo, ético y profesional y así compartir con mis compañeros un tema indispensable como curvas de valoración en sistemas acido-base complejos
Los sistemas complejos se definen como disoluciones consistentes en:
Ë Dos ácidos y dos bases de distintas fortaleza
Ë Un acido o una base que tiene dos o más grupos funcionales ácidos o básicos
Ë Una sustancia anfótera
Ë Dos ácidos y dos bases de distintas fortaleza
CURVAS DE TITULACIÓN DE SISTEMAS COMPLEJOS
Como sistemas complejos consideraremos las mezclas de ácidos o bases débiles y los ácidos o bases capaces de aportar (o reaccionar con) más de un
Protón.
En la titulación de un sistemas complejo constituido por una mezcla de ácidos de diferente fuerza acida (ejemplo: acido fuerte-acido débil), el primero que se valora con la base fuerte, es el acido fuerte, y una vez que este se consuma, la base fuerte seguirá reaccionando con el acido débil hasta que se complete la reacción.
En teoría, este tipo de sistemas puede presentar más de un punto de inflexión, siempre y cuando, la constante del acido débil sea lo suficientemente grande como para que pueda observarse el cambio alrededor del punto final.
Al igual que las curvas de titulación teórica descritas para sistemas simples, los sistemas complejos, requieren cálculos de pH puntuales a medida que el agente titulante se adiciona a la solución que contiene la mezcla.
MEZCLAS DE ACIDOS FUERTES Y DEBILES O DE BASES FUERTES Y DEBILES
En una mezcla que contiene un acido fuerte y otro débil (o una base fuerte y otra débil), es posible determinara cada uno de los componentes, siempre y cuando las concentraciones de las dos sustancias sean del mismo orden de magnitud y la constante de disociación del acido o base débil sea menor que 10-4 aproximadamente. Esta afirmación se puede demostrar con la elaboración de una curva de valoración de una disolución con concentraciones de HCl y HA aproximadamente iguales, donde HA es un acido débil con constante de disociación 10-4.
EJEMPLO 1
Calcule el PH de una mezcla que es 0.1200 M en acido clorhídrico y 0.0800 M en el acido débil HA (Ka=1.00 * 10-4) durante su valoración con KOH 0.1000 M. calcule los resultados si se añade los siguientes volúmenes de base: (a) 0.00 mL y (b) 5.00 mL
(a) Adición de 0.00 mL de KOH
La concentración molar del hidronio en esta mezcla es igual a la de HCl mas la de los iones hidronio resultantes de la disociación de HA y H2o. Sin embargo en presencia de los dos ácidos, se puede decir que la concentración de iones hidronio por la disociación del agua es mínima. Por tanto, solo es necesario considerar las otras dos fuentes del protón. Entonces se puede escribir:
Observe que [A-] es igual a la concentración de iones hidronio debido a la disociación de HA.
Ahora bien, suponga que la presencia del acido fuerte inhibe la disociación de HA hasta tal punto que [A-] << 0.1200 M, en cuyo caso:
Para verificar esta suposición se sustituye el valor provisional de [H3O+] en la expresión de la constante de disociación de HA. A l reordenar esta expresión, se obtiene:
Reorganizando esta expresión se obtiene:
Sustituyendo el valor de [HA] en la ecuación previa se obtiene
Se observa que [A-] es, efectivamente, mucho menor que 0.1200 M, como se ha supuesto.
(b) Después de añadir 5.00 mL de base
Y se podría escribir así
Para determinar si la posición es aun valida, se calcula [A-] como se realizo en la parte (a), sabiendo que la concentración de HA es ahora 0.0800 *25.00/30.00=0.0667, y se obtiene
Que es todavía mucho menor que 0.0833.
ACIDOS Y BASES POLIFUNCIONALES
Existen varias especies útiles en química analítica que tienen dos o más grupos funcionales ácidos o básicos. Por lo general, estos grupos difieren en su fortaleza y, por consiguiente, dichas especies exhiben dos o más puntos finales en una valoración acido-base.
Sistema del acido fosfórico
El acido fosfórico polifuncional característico. Experimenta las tres reacciones de disociación siguientes en disolución acuosa:
Con este acido, al igual que con otros polipróticos, Ka1 >Ka2 >Ka3.
Cuando se suman dos equilibrios sucesivos adyacentes, se multiplican las dos constantes de equilibrio para obtener la constante de equilibrio de la reacción global resultante. Por tanto, para los dos primeros equilibrios de disociación del H3PO4 se tiene
De manera similar para la reacción
Se escribiría

EJEMPLO 2
Calcule el PH de una disolución de CO2 0.02500 M. considerando el balance de masa, se tiene:

La pequeña magnitud de Khid,K1 y K2

Y se puede escribir
Considerando el balance de carga
Entonces, se supone que
Por lo tanto
Sustituyendo estas aproximaciones se obtiene
Los valores tentativos calculados de [H2CO3], [CO32-] y [OH-] indican que los supuestos son validos
CURVAS DE VALORACION DE ESPECIES ANFOTERAS
Una sustancia anfótera se puede comportar como acido débil o como base débil cuando se disuelve en un disolvente apropiado. Si sus características ácidas o básicas predominan suficientemente, es posible su valoración con una base o ácido fuerte.
EJEMPLO 3
En una disolución de dihidrogenofosfato de sodio, los equilibrios principales son:
Observe que Kb3 es demasiado pequeña para poder valorar el H2PO4- con un acido,
mientras que Ka2 es suficientemente grande para permitir su valoración con una
disolución patrón básica.
mientras que Ka2 es suficientemente grande para permitir su valoración con una
disolución patrón básica.
La situación es distinta en disoluciones que contienen hidrogenofosfato disódico, para las que los equilibrios son:
La magnitud de las constantes indica que HPO42- se puede valorar con un patrón ácido, pero no con un patrón alcalino.
referencias
videos